近日,汕头大学化学化工学院(碳中和未来技术学院)钟建基副教授团队在“钴催化非活化烯烃马氏硫氢化反应”研究领域取得新进展。相关研究成果以“N-Sulfenyl Phthalimides Enabled Markovnikov Hydrothiolation of Unactivated Alkenes via Ligand Promoted Cobalt Catalysis”为题发表在英国皇家化学会有机化学知名期刊Organic Chemistry Frontiers上,并被选为正封面(Outside Front Cover)。
论文链接:https://doi.org/10.1039/D3QO01632C
成果简介
硫醚化合物广泛应用于有机药物合成、材料科学和生命研究等领域。而通过烯烃的直接硫氢化反应是合成非对称硫醚化合物最直接和有效的方式。在最近十几年内,通过这一方法广泛构建C-S键的研究已经取得了诸多进展。相比之下,实现非活化烯烃的高效的马氏硫氢化反应一般方法的报道还很少,非活化烯烃底物范围有限、反应效率较低。实现非活化烯烃的马氏硫氢化反应的难点在于:(1)硫本身的高反应性使得硫氢化反应主要以硫自由基中间体的形式进行,与烯烃反应主要表现为反马氏选择性;(2)硫自由基对金属具有毒化作用,使得用过渡金属催化实现烯烃的马氏硫氢化反应极具挑战性。
钟建基课题组近年来致力于解决烯烃马氏硫氢化反应中的若干关键科学问题,该工作基于N-硫芳基邻苯二甲酰胺的自由基化学(Green Chem., 2023, 25, 960-965;Chin. J. Chem., 2023, 41, 1823-1828; Org. Chem. Front., 2022, 9, 4536-4541),以其作为一类新型亲自由基体,发展了配体控制的钴催化非活化烯烃的马氏硫氢化反应。通过配体调控钴中心催化活性,可以高产率、高区域选择性得到一系列支链硫醚化合物(高达99%收率)。
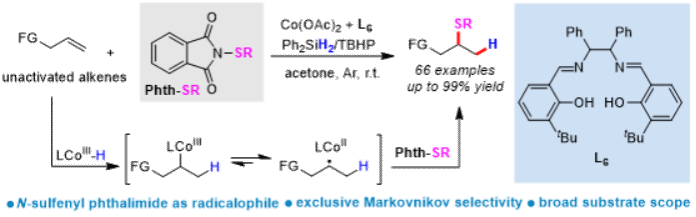
图1. 钴催化非活化烯烃的马氏选择性硫氢化
研究发现,该反应对于官能团具有很好的兼容性,带有各种官能团的非活化端烯,如芳基、烷基、卤代烷、腈基、醛、酮、羟基及其保护羟基、醚、硫醚、硅醚、酯、磺酸基、酰胺、磺酰胺、胺、硝基、有机硼酸酯和芳香杂环等都能得到相应的马氏硫氢化产物;各类1,1-二取代端烯和工业生产常用的1-己烯均能进行该反应。
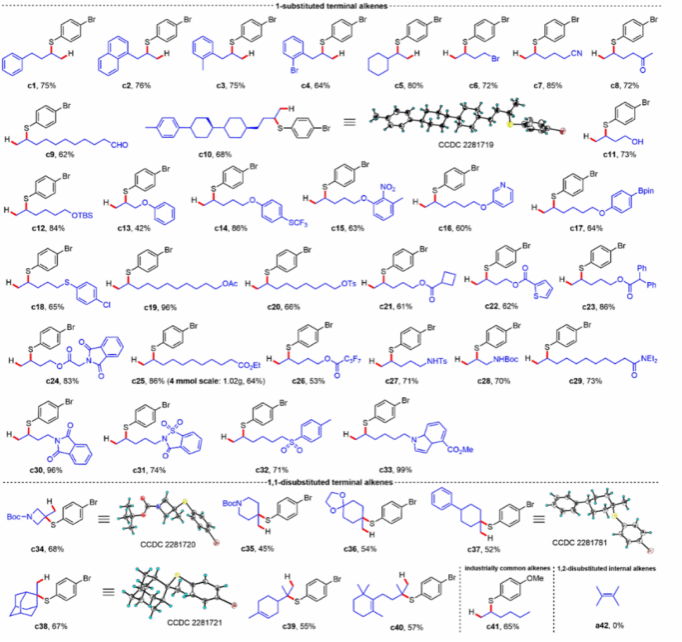
图2. 非活化烯烃底物范围
该策略同样适用于天然产物/药物分子衍生烯烃的后期官能团化修饰,同时反应得到的产物在经过几步转化可以得到其它高附加值化合物。
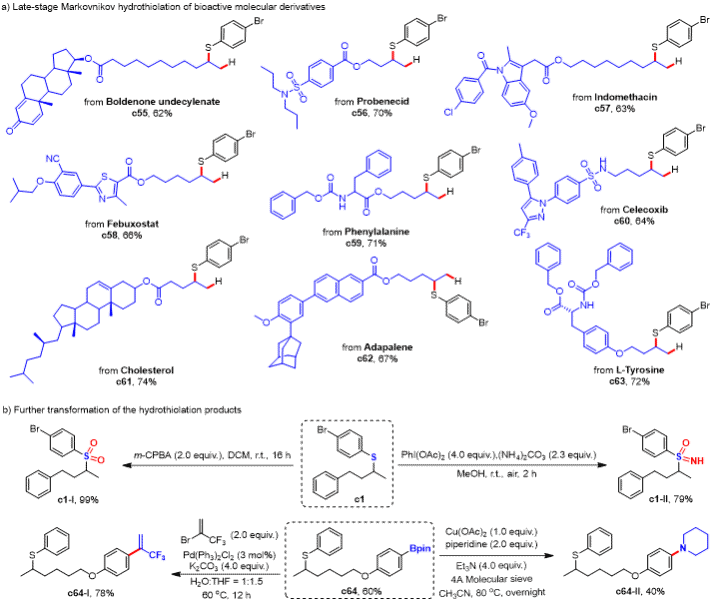
图3. 后期官能团化修饰&产物转化
本工作以N-硫芳基邻苯二甲酰胺作为新型亲自由基体,在钴氢催化下实现了非活化烯烃的马氏硫氢化反应。该方法操作简便、底物普适性好,为非对称硫醚的多样性合成提供了一种简洁、高效的合成策略。
本论文由硕士生李相睿同学和张榕津同学共同完成。本工作得到了国家自然科学基金、化学与精细化工广东省实验室的资助。

终审:鲁福身 复审:倪昊 初审:钟建基